教科書に載っている単純化された二次元の細胞の図に惑わされてはいけない。この小さな生命の構造の中には、絶えず作られ、動かされ、やがて壊される、複雑な分子機械の宇宙が広がっているのだ。
細胞は、その中にある何千種類ものタンパク質を、内部環境を形成するための道具として使っている。このような環境の中で、小器官と呼ばれる特殊な区画が、細胞の機能を担っている。細胞内の2つの重要な小器官は、ミトコンドリアと小胞体であり、それぞれエネルギーを生産し、タンパク質を組み立てている。
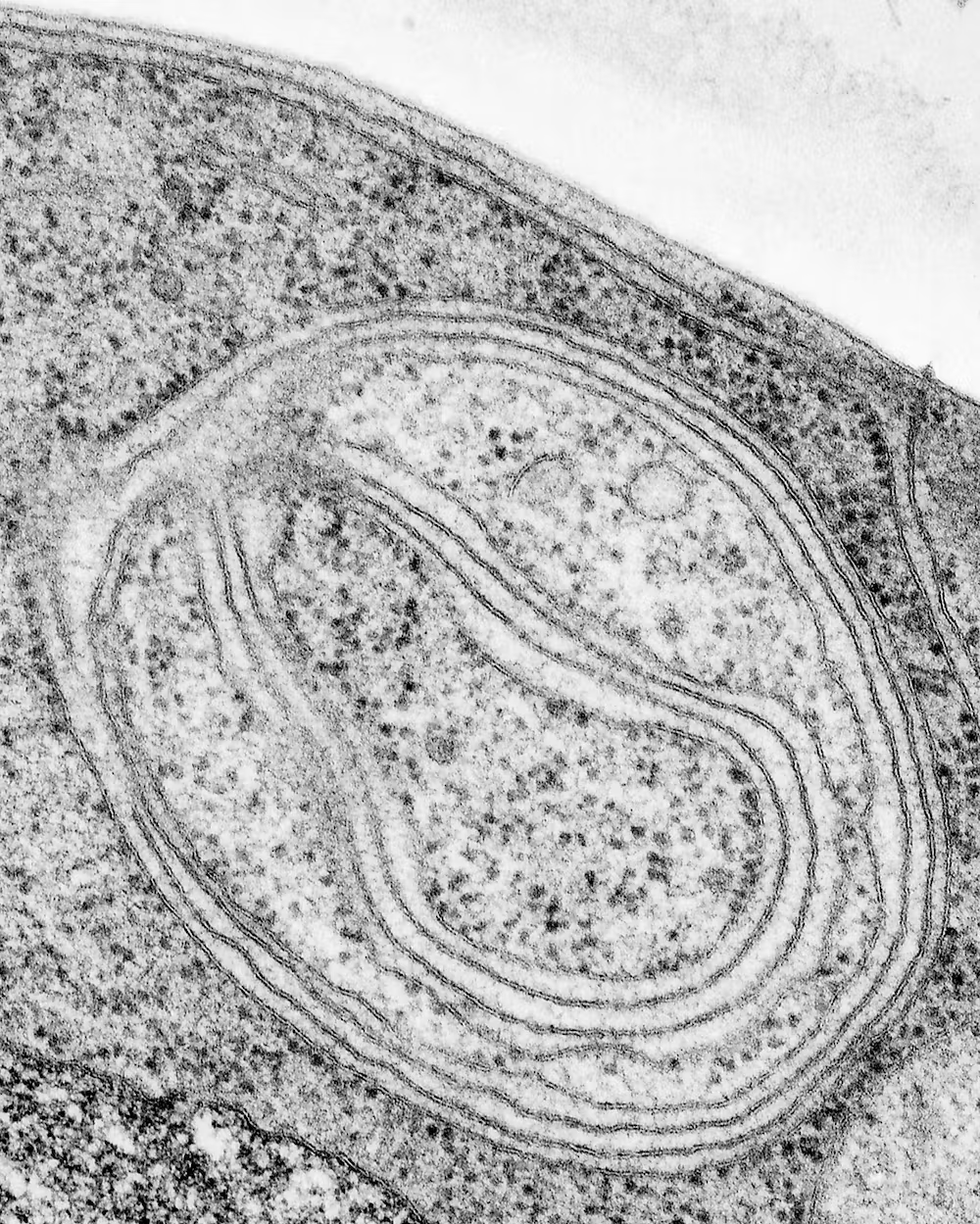
日常的な細胞活動によって有害な副産物が生成され、それが細胞にダメージを与えるため、細胞内でこれらの分子を分解して再利用する処理システムが必要とされている。オートファジーとは、細胞がタンパク質や細胞小器官などの異常成分や過剰成分を除去し、再利用するための自己消費プロセスの一つである。ギリシャ語に由来するこの言葉は、直訳すると “自食”となる。2016年、細胞生物学者の大隅良典氏は、オートファジーの研究でノーベル生理学・医学賞を受賞した。オートファジーは、細胞の健康や長寿に欠かせないものだ。このプロセスがうまく働かなくなると、神経変性疾患や心血管疾患、がんなど、いくつかのヒトの病気と関連する。
私たちは、細胞内でオートファジーがどのように活性化されるかを研究している研究者だ。最近発表した研究では、このプロセスの2つの重要な制御因子を調べ、そのうちの1つがミトコンドリアの分解に果たすユニークな役割を特定した。
オートファジーとヒトの病気
オートファジーと疾病の関係は複雑であり、十分に解明されているとは言えない。
例えば、オートファジーは癌において逆説的な役割を担っているように見える。一方では、このプロセスは潜在的に有害な物質を排除することで腫瘍を抑制するため、オートファジーの減少や障害が細胞を癌化させることがあることを示す研究もある。一方、腫瘍が形成された後にオートファジーを活性化すると、腫瘍の適応と生存を助けることによってがんを促進し、治療抵抗性につながる可能性がある。
これらの知見は、がん治療戦略としてオートファジーを標的とする場合、その正確な手順とタイミングを理解することが特に重要であることを示唆している。研究者らは、オートファジーの最終段階を阻害する2種類のマラリア治療薬、クロロキンとヒドロキシクロロキンの抗がん作用を評価している。これまでのところ、がんの種類やステージによって、その効果はさまざまだ。
オートファジーの機能不全は、ほとんどの神経変性疾患においても重要な役割を担っている。脳細胞における異常なタンパク質の凝集は、アルツハイマー病、パーキンソン病、ハンチントン病およびALSに共通する特徴である。一部の科学者は、これらのタンパク質の蓄積の少なくとも一部は、オートファジーによる分解が低下していることが原因であると考えている。
オートファジーは心臓の健康にも重要だ。研究者らは、心臓におけるオートファジーが加齢とともに低下し、心血管疾患の一因となることを発見している。心筋細胞でオートファジーが低下すると、細胞のゴミが蓄積され、収縮能力に影響を与え、死に至ることもある。細胞の数が減り、収縮力が低下すると、心筋細胞に有毒物質が蓄積し、最終的に心不全につながる可能性があるのだ。
マイトファジーでミトコンドリアを分解する
オートファジーを効率的に行うには、細胞内の損傷したタンパク質や小器官だけを特別に取り除く必要がある。無秩序な分解は、細胞の基本的な必要性を奪ってしまう。
特にミトコンドリアは、細胞のエネルギー生産の大部分をミトコンドリアに依存しているため、この傾向は顕著だ。私たちのチームは、ミトコンドリアのオートファジー(マイトファジーとも呼ばれる)が、健全な部分を残しながら機能不全のミトコンドリアだけを除去することを、細胞がどのようにして実現しているかに大きな関心を持っている。マイトファジーの機能不全は、がん、神経変性、心血管疾患などの疾患と関連があるとされている。
オートファジーのプロセスは、細胞が損傷したタンパク質や小器官の近くに膜を形成し始めるところから始まる。この膜は、オートファゴソームと呼ばれる小胞または袋へと膨張し、損傷した物質を包み込む。その後、オートファゴソームは、リソソームと呼ばれる酸で満たされた別の細胞内構造物と融合し、その積荷を分解するのを助ける。
ベクリン1 は、細胞内でオートファゴソームの形成を促進することが知られているタンパク質である。しかし、その近縁種であるベクリン2についてはほとんど知られていないこともあり、マイトファジーにおけるその役割については議論の余地がある。私たちは、この2つのタンパク質の機能を分離し、マイトファジーにおける役割を明らかにしたいと考えた。そのために、マウスとヒトの細胞モデルを用いて、この2つのタンパク質の有無がオートファジーにどのような影響を与えるかを調べた。
その結果、ベクリン1に固有の領域を活性化することで、機能不全のミトコンドリアの隣にオートファゴソームを形成し、ヒト細胞での分解を促進することを発見した。同様の領域はベクリン2には存在しないため、ベクリン1のみがマイトファジーに必須である可能性が示唆された。
また、興味深いことに、マイトファジーの際にミトコンドリアと小胞体が接触している箇所にもベクリン1が存在していることが確認された。これは、これらの小器官の物理的な相互作用が、オートファゴソームを作るために必要な特定の分子の移送を促進することを示唆する新しい研究を支持するものである。私たちの研究は、ベクリン1だけがこれらの部位で損傷したミトコンドリアの取り込みを促進することを示している。ベクリン2は、他の条件下ではオートファジーにおいて異なる役割を担っている可能性がある。
オートファジーを標的とした治療法
オートファジーは、さまざまな疾患の治療ターゲットとなる可能性がある。私たちのチームは現在、オートファジーが心臓のタンパク質凝集やミトコンドリア機能障害にどのように寄与しているかを研究しており、細胞や動物モデルでこのプロセスを測定するための新しいツールの開発に取り組んでいるところだ
しかし、オートファジーは多くの異なるタンパク質が関与する複雑な多段階のプロセスであるため、オートファジーを制御する治療戦略は複雑だ。ある疾患ではオートファゴソーム形成の初期段階を標的とする必要があるかも知れないし、ある疾患ではオートファゴソームがリソソームと融合する時期に着目する必要があるかも知れない。さらに、異なる病態では、オートファジーの活性化または阻害のいずれかが有効である可能性もある。オートファジー経路の各段階を制御する特定のタンパク質をすべて特定し、健康な状態でも病気でも、細胞がこのプロセスをどのように微調整しているのかを明らかにするためには、さらなる研究が必要である。
私たちは、複雑な分子世界の中で、細胞がオートファジーの力をうまく利用できるようにすることが、健康や長寿を促進するために3つのR(reduce, reuse, recycle)を守るように細胞を訓練することができると考えている。







コメントを残す